1 – Définitions :
Corps pure : un corps pur est composé homogène d'un seul type de constituant. Il peut être selon les conditions de T° et de Pression sous trois états physiques : solide, liquide ou gazeux.
- Système : il peut être formé d’un corps pur ou d’un mélange de corps pures.
Notion de phases : Dans le cas d’un corps pur : Une phase est l’état physique sous lequel on trouve la matière. L’état peut être :
o Solide
o Liquide
o Gazeux
Dans le cas d’un mélange de deux ou plusieurs constituants, la phase est l’état sous le quel on trouve un constituant donné de ce mélange. On a autant de phases que de constituants indépendants. Si deux ou plusieurs constituants forment un mélange homogène, alors ce mélange sera considéré comme une seule phase
Phase gazeuse.
Tous les gaz sont miscibles en toutes proportions. Une phase gazeuse peut avoir un ou plusieurs constituants : air (N2, O2, H2O…).Phase liquide.
Certains liquides sont miscibles entre eux : eau + alcool (1 phase), d’autres non : eau + huile (2 phases).Phase solide.
En général les solides sont non miscibles et il y a autant de phases que de constituants sauf dans le cas des solutions solides (alliages).
2 Diagramme des phases :
Un diagramme de phases est une représentation graphique des phases sous lesquels on retrouve les constituants d’un système en fonction des variables d’état du système. Ces variables peuvent être la température , la pression, la concentration des constituants …
2-1 Diagramme de phase d'un corps pure :
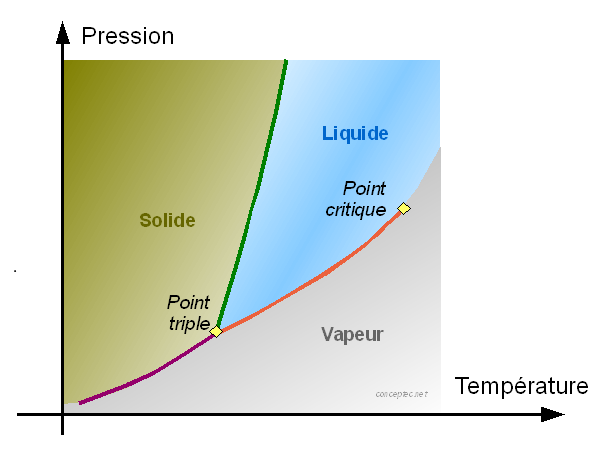
Un corps pure peut avoir à une température et une pression données un ou deux ou trois états physiques en équilibre et ce selon les cas suivant :
au point triple : équilibre des trois phases :liquide + solide + vapeur
sur les lignes : équilibre de deux phases qui peuvent être :
solide + vapeur : à basse température et basse pression :
solide + liquide : à haute pression température moyenne
vapeur + liquide : à hautes températures et moyennes pressions.
(ici la notion de haute, moyenne et basse sont relatives au corps à étudier)
sur les surfaces : le corps a un seul état physique qui est soit solide ou liquide ou vapeur.
Point critique : la courbe de changement d'état liquide-vapeur s'interrompt en un point appelé point critique, au-delà duquel le corps ne présente plus qu'une seule phase fluide, plutôt proche (du point de vue de ses propriétés physiques) d'un gaz aux pressions inférieures à la pression critique, plutôt proche d'un liquide aux pressions supérieures à la pression critique.
2-1-1 Définitions : La figure suivante donne la définition des passages entre les phases :
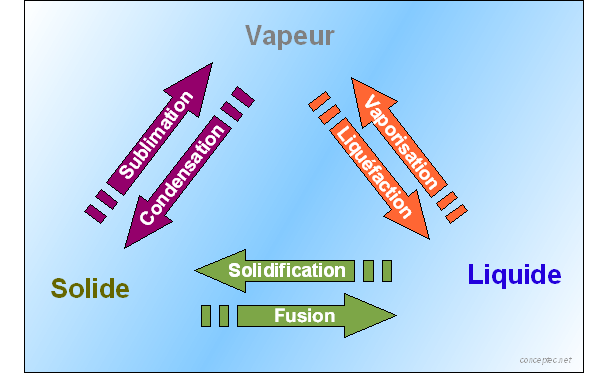
2-1-2 Remarques :
- Généralement, les courbes de changement de phases P=f(T) sont croissantes. Une exception notable est celle de l'eau, pour laquelle la courbe de fusion - solidification est décroissante (ceci vient du fait que la glace flotte sur l'eau liquide).
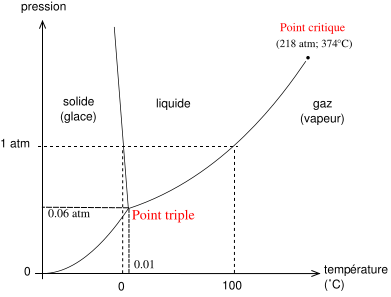 (image wikipédia)
(image wikipédia)- À l'état solide, un corps peut parfois prendre plusieurs formes de cristallisation,(structure interne du solide) en fonction de la pression et de la température. Chaque forme de cristallisation constitue ainsi une phase différente, ce qui permet de tracer un diagramme de phase.
2-1 Diagramme binaire :
L'état physique d'un corps pure dépend de sa température et de sa pression. Deux matériaux différents n'ont pas les mêmes températures de changement de phase à ne pression donnée ou inversement. Autrement deux matériaux différents n'ont pas le même diagramme de phase. Supposons qu'on va effectuer un "mélange" de deux corps purs A et B avec des proportion données ce qui va former un nouveau système (A+B). chquun des deux corps peut avoir à une température et pression données un état physique différent.
Lorsque l'on a un système composé de deux corps purs, le système peut être sous plusieurs formes :
- entièrement solide, chaque corps cristallisant séparément ;
- entièrement solide, les deux corps étant parfaitement mélangés sous la forme d'une solution solide ou d'un composé défini, appelé eutectique, eutectoïde, péritectique ou péritectoïde selon la manière dont il se décompose en chauffant ;
- mélange solide-liquide ;
- entièrement liquide, sous la forme de deux liquides non miscibles (émulsion), ou d'un seul liquide parfaitement homogène (une seule phase, solution) ;
- mélange liquide-gaz (aérosol, ou bien gaz au-dessus d'un liquide) ;
- gaz (un gaz est toujours homogène pour de faibles variations d'altitude).
Les états ci-dessus sont composés soit d'une phase unique (par exemple liquides miscibles ou gaz), soit de plusieurs phases hétérogènes. On peut tracer de même l'état d'un système en fonction de la pression, de la température et de la composition.
Avec n corps purs, nous avons n concentrations, mais seulement n+1 paramètres indépendants avec la pression et la température ; en effet, la somme des concentrations vaut 100 %, et l'une des concentrations peut se déduire des autres et ne constitue donc pas un paramètre indépendant.
Il faudrait donc un diagramme à n+1 dimensions pour représenter ces n+1 paramètres indépendants (3 dimensions pour deux corps purs, 4 dimensions pour trois corps purs). Pour simplifier la représentation, un nombre suffisant de paramètres sont fixés afin de tracer un diagramme à deux dimensions ; on considère souvent les diagrammes suivants :
- pour une composition donnée, le diagramme de phase pression-température (P,T), similaire à ce qui a un diagramme de corps pur ;
- pour une pression donnée et deux corps purs, le diagramme binaire composition-température (c,T) ;

 Mon catalogue
Mon catalogue 

























 40795
40795  Mohamed Wissem LANDOLSI
Mohamed Wissem LANDOLSI 